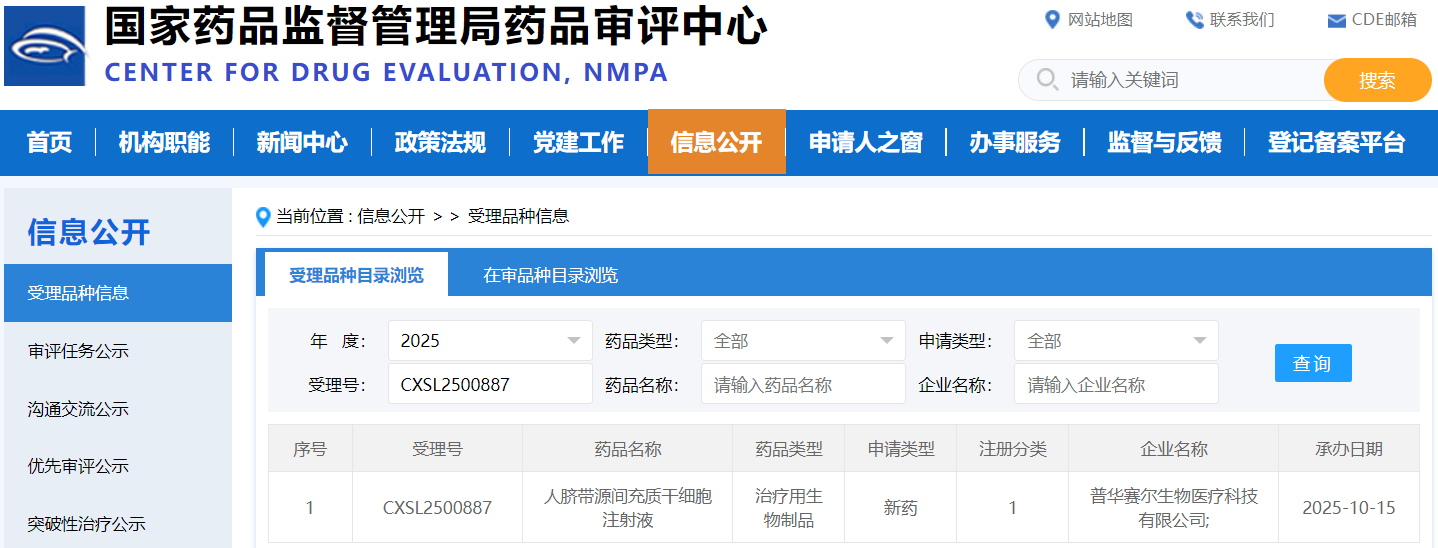
近日,普华赛尔生物医疗科技有限公司宣布,其自主研发的干细胞新药“人脐带源间充质干细胞注射液”临床试验申请,已于 2026 年 1 月 5 日正式获得国家药品监督管理局批准(受理号:CXSL2500887)。这一重要进展标志着我国在干细胞创新药物研发领域迈出了坚实一步,也为相关疾病的治疗提供了新的可能。
全式金生物依托在细胞培养与质量控制领域的深厚技术积淀,为该新药研发提供了核心试剂支撑——包括高质量支原体提取与检测试剂、间充质干细胞三向分化试剂。这些产品在细胞制备的污染防控、生物学特性验证等关键环节发挥了不可或缺的作用,助力普华赛尔构建起符合国家法规要求、体系完整的质量控制与工艺验证方案,为临床申报奠定了坚实基础。
核心产品赋能
• 操作简单,无需离心,提取速度快。
• 提取量高,纯度高,回收率高。
• 符合欧洲药典 EP 2.6.7 和日本药典 JP G3 检测要求。
• 覆盖范围广:可覆盖至少 129 种支原体 DNA 序列。
• 灵敏度高:检测限可达 10 CFU/ml,质粒标准品可达 1 copy/μl。
• 特异性高:常见近 20 种细菌、生产用细胞等基因组无检测干扰。
• 稳定性高:产品至少可冻融 15 次,产品性能无明显影响。
• 防污染系统:含 dUTP/UDG,有效防止 PCR 产物污染。
人间充质干细胞成脂/成骨/成软骨分化培养基 (MM201/MM301/MM401)
• 普适性强:可适用于脐带、骨髓、脂肪等多种不同来源的人间充质干细胞的分化。
• 分化稳定:分化效率高且周期短。
• 稳定性强:配制好的完全培养基在 4℃ 放置 1 个月,仍具有较好的诱导效果。
• 适用于不同级别培养基培养的 MSCs 分化能力鉴定。
全式金生物始终致力于为细胞与基因治疗领域提供可靠、高效的试剂与技术支持。此次与普华赛尔的成功合作,再次印证了公司在相关技术链条中的专业价值与产品可靠性。我们深切认同“科学、严谨、创新、共赢”的行业精神,并持续通过扎实的技术与产品输出,赋能合作伙伴将具有临床价值的创新疗法走向现实。
在此,祝贺普华赛尔取得阶段性重大成果,期待该干细胞药物后续临床研究顺利推进。未来,全式金生物将继续深化在生物医药关键试剂领域的技术布局与创新突破,与行业同仁携手,共同促进中国生物医药产业的高质量发展。







